Inspekcje zagraniczne GIF
09.01.2026
Produkty lecznicze dopuszczone do obrotu na rynku polskim bez względu na to, czy zostały wytworzone na terenie państw członkowskich Unii Europejskiej/Europejskiego Obszaru Gospodarczego, czy w kraju trzecim takim jak np. Chiny, Indie, Wietnam lub Korea Południowa muszą być wytwarzane zgodnie z europejskimi wymaganiami Dobrej Praktyki Wytwarzania.

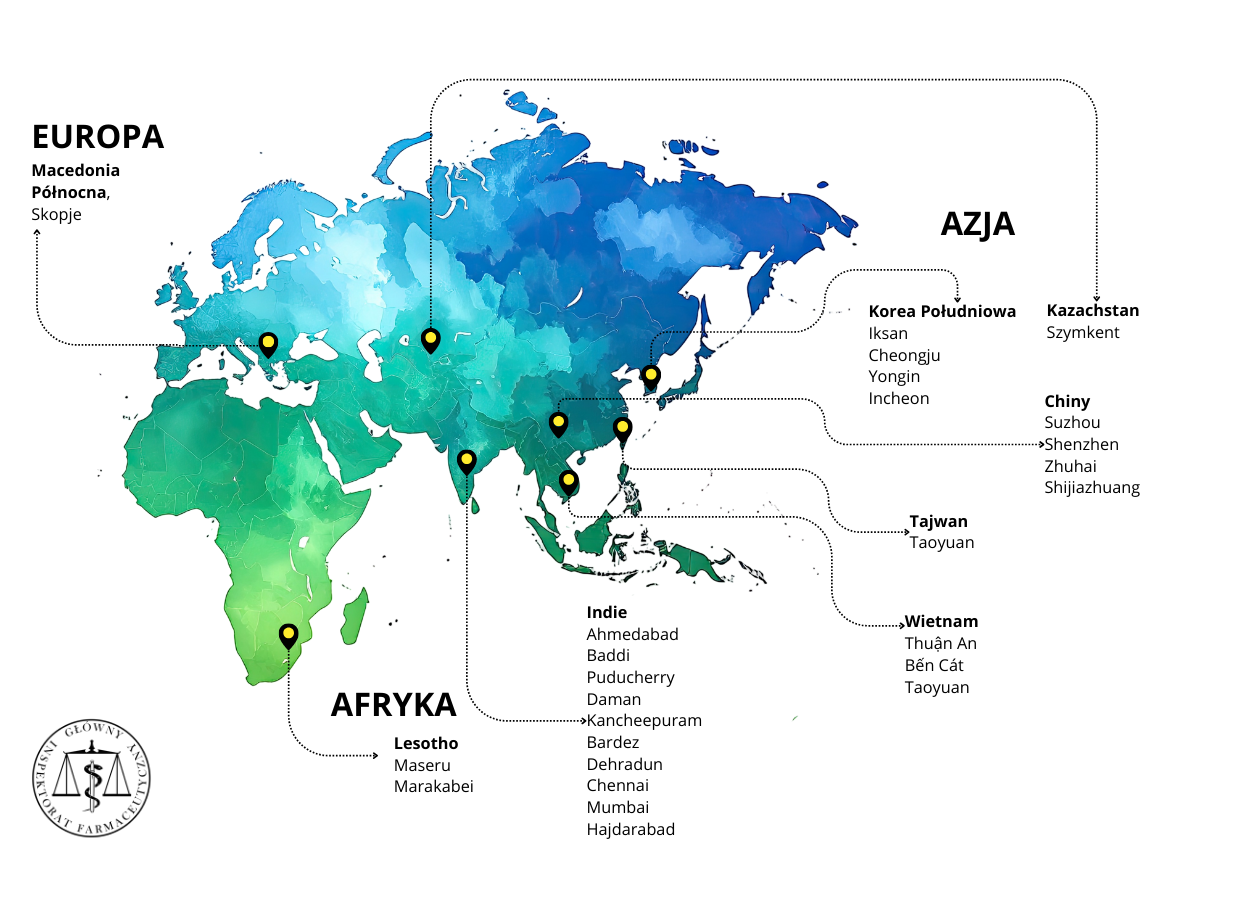
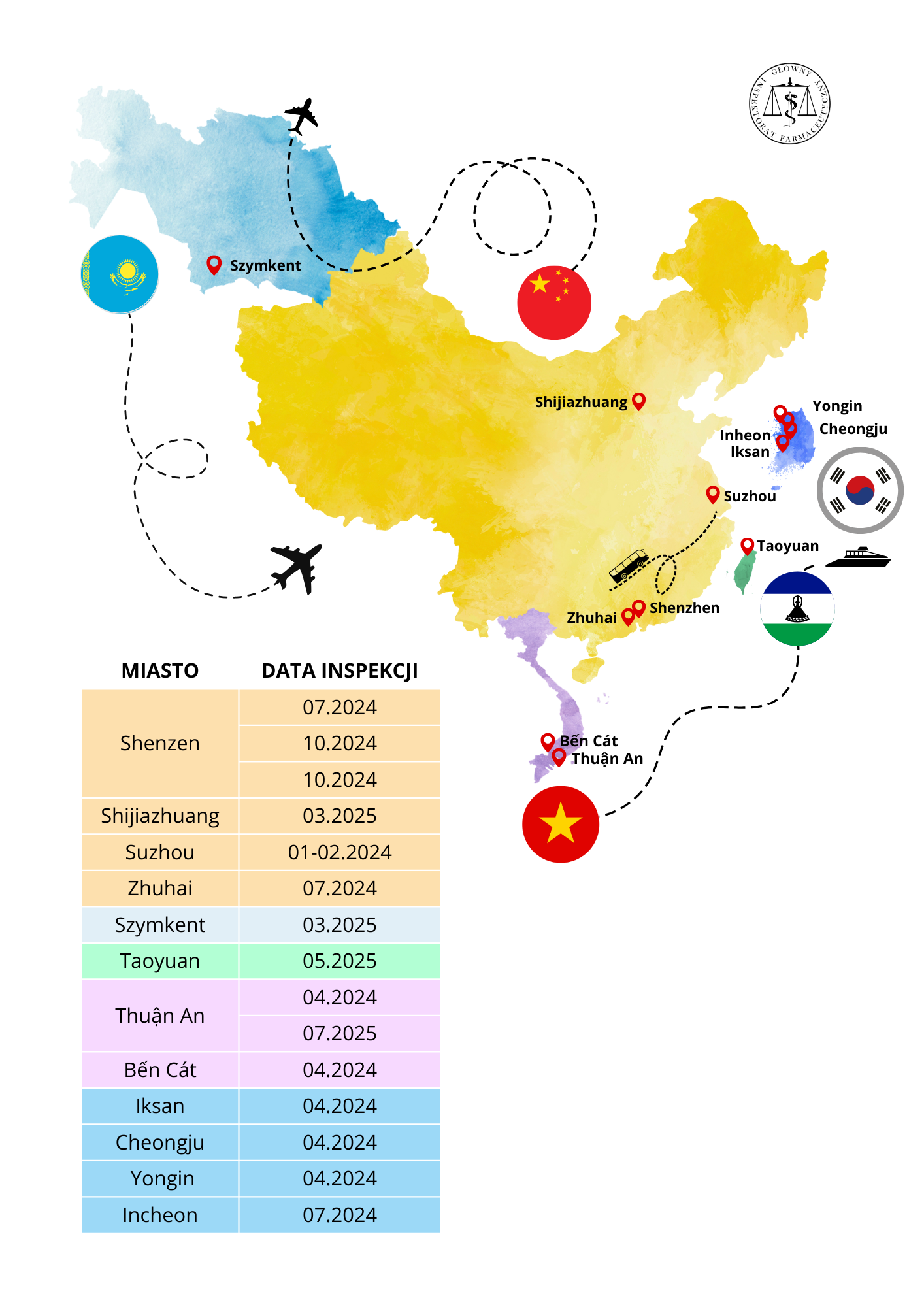
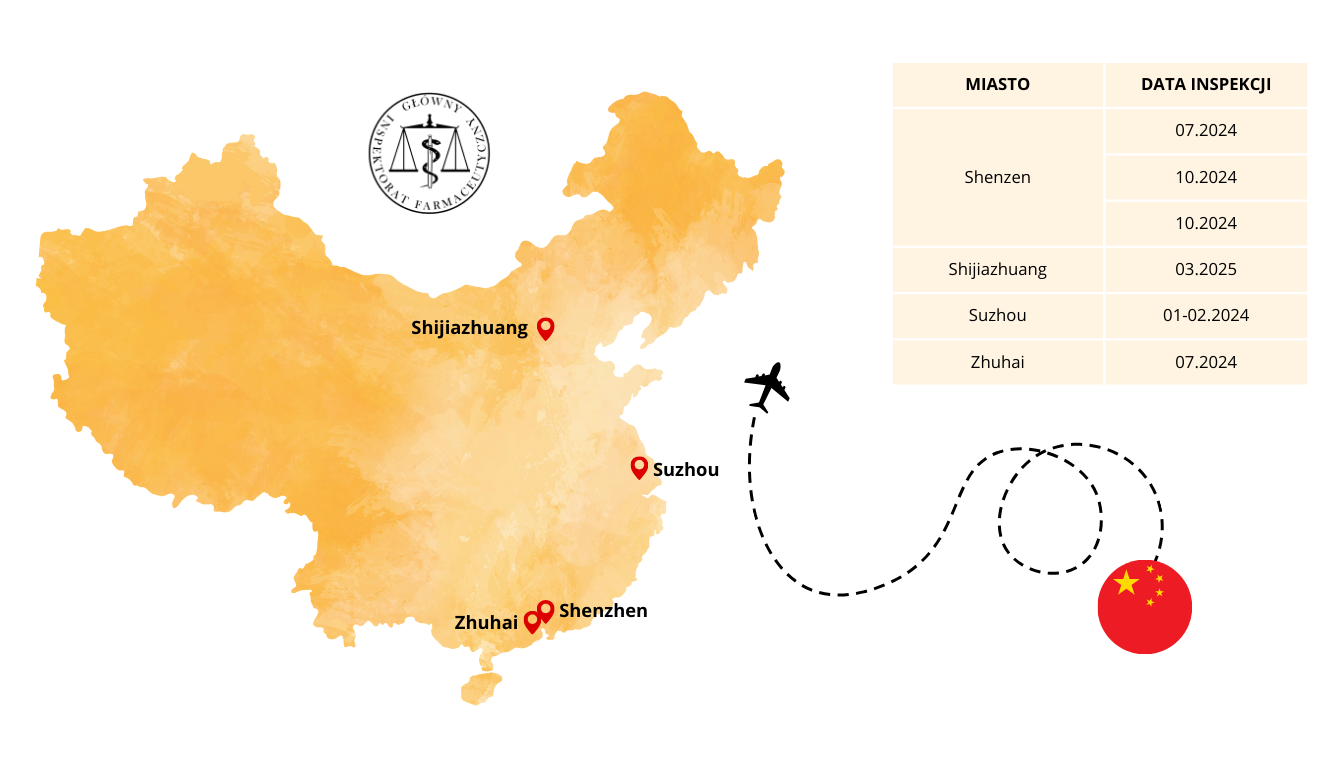
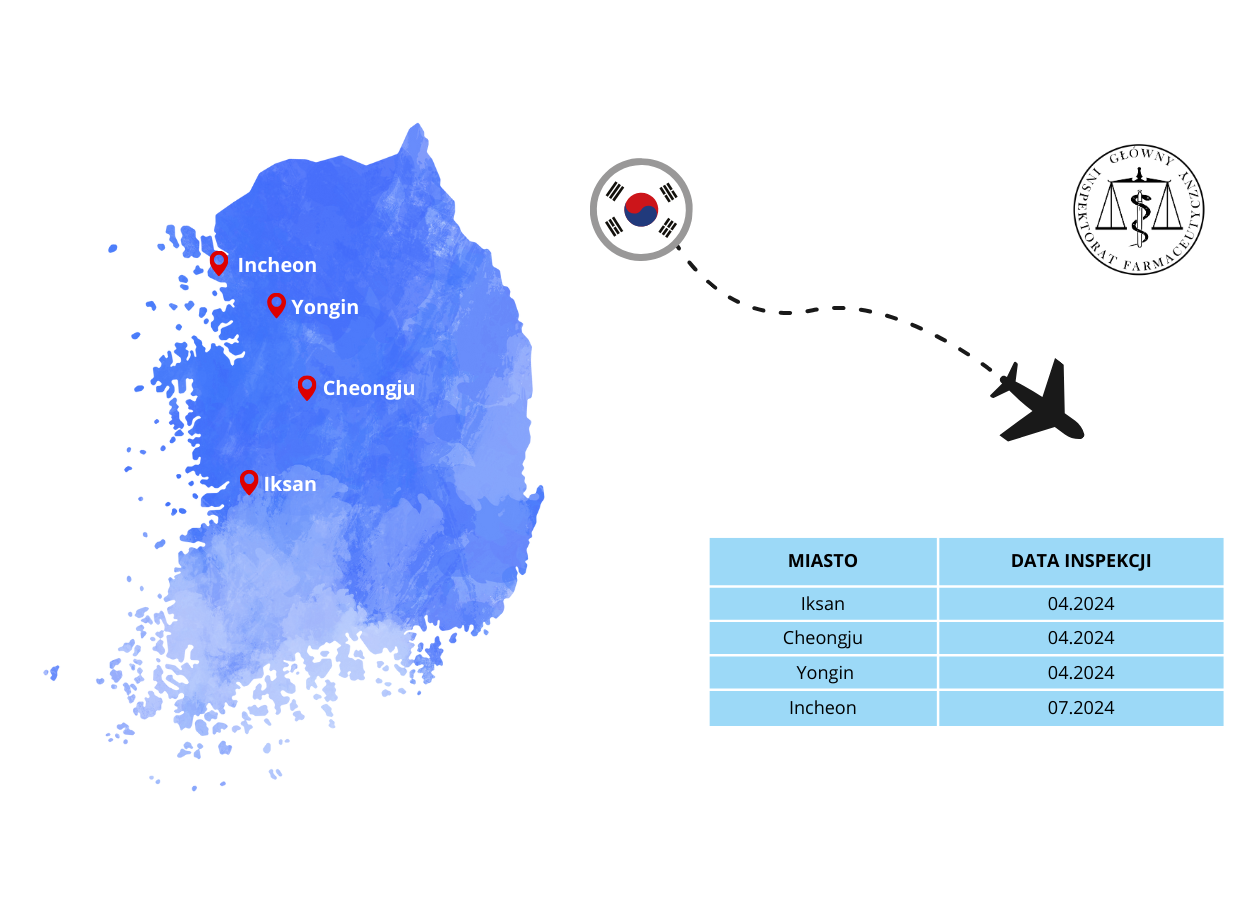
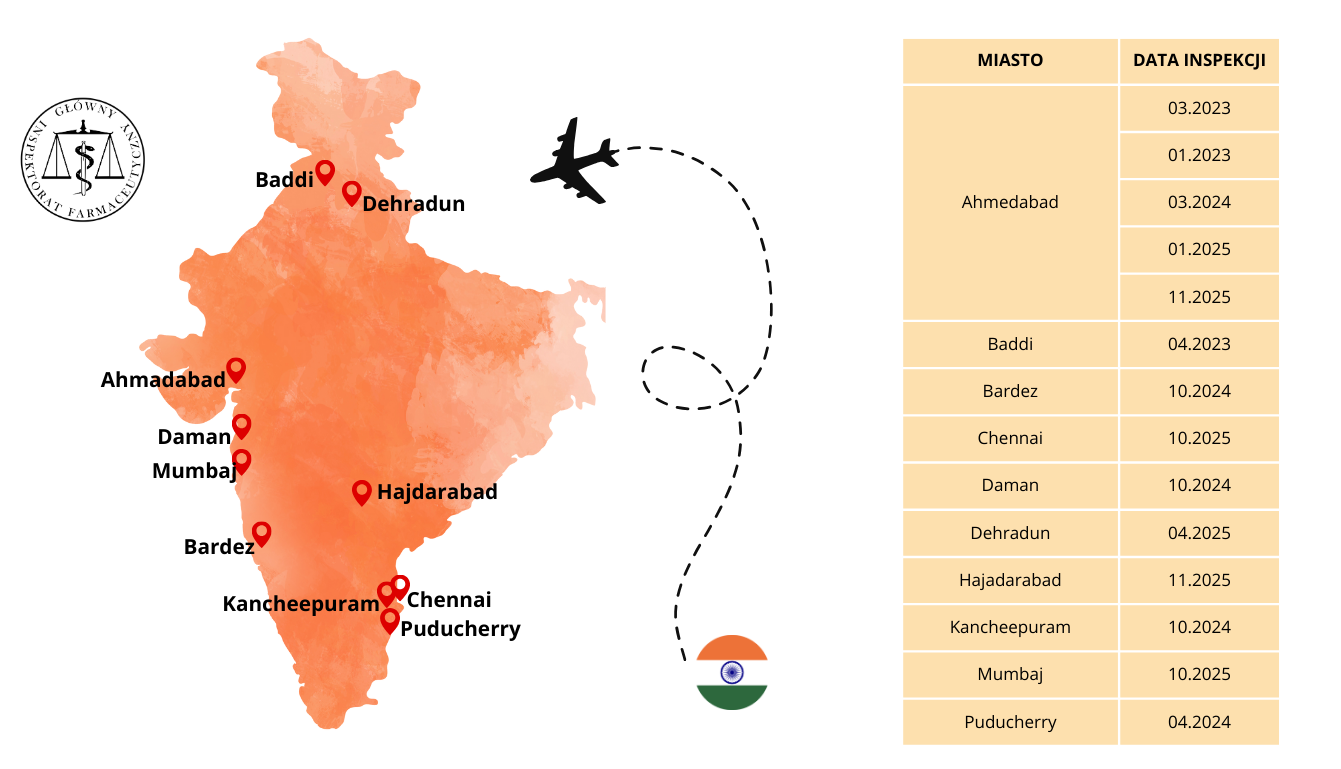
Sprawdzenie i potwierdzenie, że wytwórcy w krajach trzecich spełniają powyższe wymagania, ważne z punktu widzenia jakości, bezpieczeństwa i skuteczności produktów leczniczych jest jednym z zadań realizowanych przez GIF. Tylko w latach 2024-2025, w celu przeprowadzenia inspekcji w krajach trzecich, nasi inspektorzy ds. wytwarzania pokonali łącznie 370 tys. kilometrów, czyli odległość porównywalną do ponad 9-krotnego okrążenia Ziemi wzdłuż równika. Prowadzili w tym czasie inspekcje na 3 kontynentach, w 8 krajach, pokonując przy tym 7 stref czasowych.
Inspekcje u wytwórcy produktu leczniczego, prowadzącego działalność w kraju trzecim przeprowadzane są na wniosek:
- podmiotu odpowiedzialnego, gdy wystąpił on z wnioskiem o uzyskanie pozwolenia na dopuszczenie do obrotu produktu leczniczego lub zmianę pozwolenia w zakresie zmiany miejsca wytwarzania w kraju trzecim,
- importera produktu leczniczego, gdy produkt leczniczy jest sprowadzany na terytorium Rzeczypospolitej Polskiej z kraju trzeciego,
- państwa Unii Europejskiej/Europejskiego Obszaru Gospodarczego, Europejskiej Agencji Leków lub Komisji Europejskiej.
Celem tych inspekcji jest wydanie opinii o zgodności warunków wytwarzania z wymaganiami GMP (Dobrej Praktyki Wytwarzania). W przypadku pozytywnej opinii po inspekcji wydawany jest certyfikat GMP, który jest także umieszczany w ogólnodostępnej europejskiej bazie EudraGMDP.
Posiadanie takiego certyfikatu jest koniecznym warunkiem dopuszczenia leku do obrotu na terenie Polski. Jego posiadanie daje pewność, że wytwórcy produktów leczniczych w krajach trzecich spełniają rygorystyczne wymagania Dobrej Praktyki Wytwarzania obowiązujące w Unii Europejskiej.